Paul Dirac'ın kuantum mekaniğini Einstein'ın Özel Görelilik Teorisi ile bir araya getirerek göreli kuantum mekaniğini oluşturması 20. yüzyılın biliminin en büyük anlarından biridir. Dirac'ın teorisi; elektron dönüşünü ve pozitronu tahmin etmek, atomik çarpışmaları analiz etmek ve kuantum elektrodinamiğindeki devrime öncülük etmek gibi birçok iş yaptı, ama aynı zamanda kimya için çok önemli yansımaları oldu. Ne var ki kimyadaki çoğu problemi çözmek için göreliliğin ihmal edilebileceğinin ortaya çıkmasıyla birlikte, bu yansımalar birkaç on yıl daha gündeme gelmedi. Kimyasal bağların bulunması, moleküllerin termodinamik özelliklerinin ve kimyasal tepkime hızlarının tahmin edilmesi, kimyasal proteinleri bir arada tutan moleküler gücün anlaşılması gibi problemlerin hepsi, kimyagerlerin göreliliği göz ardı etmesine rağmen çözülebildi.
Tek bir problem dışında hepsi, tabii ki. Antik çağlardan beri her çocuğun sormuş olduğu bir soru: "Cıva neden oda sıcaklığında sıvı haldedir?" Bu özelliğe sahip tek metal olan cıva, yüzyıllar boyunca insanları büyülemiştir. Yerçekimi ile akan, madeni paralara ağırlığını veren, diğer metalleri adeta sihirli bir şekilde çözebilen ve bir araya toplanıp kaldırılmaya direnen, ışıltılı bir madde. Bir termometrenin içinde kalibre edildiğinde sağlığımıza katkı sağlayabilen, bir dokuda biriktiğinde ise ölümcül olabilen bir madde. Ancak cıva hakkında en küçük bir bilgisi olan herkesin aşina olduğu tek özelliği, oda sıcaklığında sıvı halde olmasıdır.
Peki neden? Görüşüne göre, bazen bilimdeki en temel gözlemlerin bile, karmaşık ama bir o kadar da ilginç açıklamaları olabiliyor, bu da o durumlardan bir tanesi. Neyse ki bu durumun çok da karışık olmayan bir açıklaması var ve Angewandte Chemie dergisinde yayınlanan bir makale, bunu eksiksiz ve tatmin edici bir şekilde anlatıyor.
Hatta cıva, çinko ve kadmiyum ile aynı grupta bulunmasına rağmen onlardan son derece farklıdır. Çinko ve kadmiyum oda sıcaklığında sıvı halde değildirler ve cıvadan farklı bir şekilde kristalleşirler. Ayrıca cıva periyodik tabloda altının hemen yanında bulunur, ama özellikleri tamamen birbirinden farklıdır.
Kimya derslerinden dört farklı atomik orbital çeşidinin bulunduğunu hatırlayın: s, p, d ve f orbitalleri. Bu orbitaller, farklı kuantım sayıları ve farklı şekilleriyle birbirinden ayırt edilirler. Metaller, çok sayıda ve dolu d orbitaline sahip olmalarıyla karakterize edilir. Ayrıca, dolu orbitaller, özel bir stabilitenin varlığını ima eder. Cıvayı komşularından ayırt eden tek olgu, en dıştakı 6s atomik orbitalinin dolu olmasıdır. Bu, o yörüngedeki elektronlarının mutlu bir şekilde birbirleriyle eşleştikleri ve komşu cıva atomlarıyla paylaşılmaya isteksiz oldukları anlamına gelir.
Görelilik teorisinin devreye girdiği yer, cıvadaki elektronların kütlelerinde ve atom yarıçaplarında meydana gelen, ve derin etkileri olan, küçük değişikleri de hesaba katmasıdır.
Bohr'un teorisinde bir elektron yörüngesinin yarıçapı kütle ile ters orantılı olduğu için, bu kütle artışı, yörünge yarıçapının %23 küçülmesine sebep olur. Bu küçülme, çok sayıda değişikliğe sebep olur: Öncelikle, küçülmeden dolayı çekirdek ve elektronlar arasında daha güçlü bir çekim oluşur. Bu çekim, en dıştaki 6s orbitali dahil bütün orbitalleri etkiler. Daha dağınık olan d ve f orbitallerinin s elektronlarını korumakta yetersiz kalması, bu etkinin katlanarak artmasına sebep olur. Bu küçülme, 6s orbitalinin dolu olmasıyla birleştiğinde, cıvayı en dıştaki elektronlarını paylaşarak diğer cıva atomlarıyla güçlü bağlar kurmaya gerçekten çok isteksiz bir hale getirir.
Ancak bütün bunlar bir varsayımdı, birinin elementteki her bir elektronu göreli olarak ele alarak hesaplamaları titizlikle yapması ve ilgili özellikleri hesaplaması gerekiyordu. Bu durumda ilgili özellik, katıdan sıvıya geçiş gibi faz geçişleri sırasında değeri çarpıcı bir şekilde değişen ısı sığasıydı.
Eldeki soru basitti: En modern hesaplamaları kullanarak, ısı sığasındaki ani bir değişimi kullanarak cıvanın erime noktasını hesaplayabilir miyiz?
Angewandte Chemie dergisinde yayınlanan makalede; Yeni Zelandalı, Alman ve Fransız kimyagerler, bugüne kadarki en eksiksiz sonucu elde ettiler. Cıvanın erimesini, kuantum moleküler dinamiklerini kullanarak, Schrödinger denklemini çözerek, kuantum mekaniğinden kuvvetleri ve hızları hesaplayarak ve atomik kümelerin rastgele farklı yönelimleri örneklemesine izin vererek simüle ettiler. Hesaplamaları önce göreliliği dahil etmeden ve daha sonra dahil ederek gerçekleştirdiler - ve sonuçlar netti: Görelilik hesaba dahil edildiğinde, cıvanın erime noktası, deneyle mükemmel bir uyum içinde ve ısı sığasındaki ani bir değişiklikle birlikte 355 Kelvin'den 250 Kelvin'e düşmüştü.
Kaynak: Evrim Ağacı
Tek bir problem dışında hepsi, tabii ki. Antik çağlardan beri her çocuğun sormuş olduğu bir soru: "Cıva neden oda sıcaklığında sıvı haldedir?" Bu özelliğe sahip tek metal olan cıva, yüzyıllar boyunca insanları büyülemiştir. Yerçekimi ile akan, madeni paralara ağırlığını veren, diğer metalleri adeta sihirli bir şekilde çözebilen ve bir araya toplanıp kaldırılmaya direnen, ışıltılı bir madde. Bir termometrenin içinde kalibre edildiğinde sağlığımıza katkı sağlayabilen, bir dokuda biriktiğinde ise ölümcül olabilen bir madde. Ancak cıva hakkında en küçük bir bilgisi olan herkesin aşina olduğu tek özelliği, oda sıcaklığında sıvı halde olmasıdır.
Peki neden? Görüşüne göre, bazen bilimdeki en temel gözlemlerin bile, karmaşık ama bir o kadar da ilginç açıklamaları olabiliyor, bu da o durumlardan bir tanesi. Neyse ki bu durumun çok da karışık olmayan bir açıklaması var ve Angewandte Chemie dergisinde yayınlanan bir makale, bunu eksiksiz ve tatmin edici bir şekilde anlatıyor.
Cıvanın Kimyasal Temelleri
Ama öncelikle temellere geri dönelim: Cıva bir metaldir, dolayısıyla altın, çinko ve kadmiyum gibi diğer metallerle birlikte periyodik tablonun orta kısmında bulunur:
Hatta cıva, çinko ve kadmiyum ile aynı grupta bulunmasına rağmen onlardan son derece farklıdır. Çinko ve kadmiyum oda sıcaklığında sıvı halde değildirler ve cıvadan farklı bir şekilde kristalleşirler. Ayrıca cıva periyodik tabloda altının hemen yanında bulunur, ama özellikleri tamamen birbirinden farklıdır.
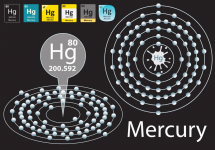
Kimya derslerinden dört farklı atomik orbital çeşidinin bulunduğunu hatırlayın: s, p, d ve f orbitalleri. Bu orbitaller, farklı kuantım sayıları ve farklı şekilleriyle birbirinden ayırt edilirler. Metaller, çok sayıda ve dolu d orbitaline sahip olmalarıyla karakterize edilir. Ayrıca, dolu orbitaller, özel bir stabilitenin varlığını ima eder. Cıvayı komşularından ayırt eden tek olgu, en dıştakı 6s atomik orbitalinin dolu olmasıdır. Bu, o yörüngedeki elektronlarının mutlu bir şekilde birbirleriyle eşleştikleri ve komşu cıva atomlarıyla paylaşılmaya isteksiz oldukları anlamına gelir.

Görelilik teorisinin devreye girdiği yer, cıvadaki elektronların kütlelerinde ve atom yarıçaplarında meydana gelen, ve derin etkileri olan, küçük değişikleri de hesaba katmasıdır.
Özel Görelilik Teorisi, Cıvayı Sıvı Yapıyor!
Özel göreliliğe göre, bir nesnenin hızı ışık hızına yaklaştıkça, görünen kütlesi de artar. Niels Bohr'un atom yapısı teorisinden, bir elektronun hızının, o elementin atom numarasıyla orantılı olduğunu biliyoruz. Hidrojen (atom numarası 1) gibi hafif elementler için elektron hızı, ışık hızına kıyasla önemsizdir, dolayısıyla görelilik ihmal edilebilir. Ancak cıvanın (atom numarası 80) 1s elektronunda bu etki önemli bir hale gelir. Elektron, ışık hızının yaklaşık %58'ine ulaşır, kütlesi ise, dinlenme halindeki kütlesinin 1.23 katına ulaşır. Artık göreliliğe ihtiyacımız vardır.Bohr'un teorisinde bir elektron yörüngesinin yarıçapı kütle ile ters orantılı olduğu için, bu kütle artışı, yörünge yarıçapının %23 küçülmesine sebep olur. Bu küçülme, çok sayıda değişikliğe sebep olur: Öncelikle, küçülmeden dolayı çekirdek ve elektronlar arasında daha güçlü bir çekim oluşur. Bu çekim, en dıştaki 6s orbitali dahil bütün orbitalleri etkiler. Daha dağınık olan d ve f orbitallerinin s elektronlarını korumakta yetersiz kalması, bu etkinin katlanarak artmasına sebep olur. Bu küçülme, 6s orbitalinin dolu olmasıyla birleştiğinde, cıvayı en dıştaki elektronlarını paylaşarak diğer cıva atomlarıyla güçlü bağlar kurmaya gerçekten çok isteksiz bir hale getirir.

Cıvanın Moleküler Etkileşimleri
Küçük kümelerdeki cıva atomları arasındaki bağlar, genellikle elektron paylaşımının değil, komşu atomlarda meydana gelen yerel yük değişimleri sonucu oluşan zayıf Van der Waals kuvvetlerinin sonucudur.Ancak bütün bunlar bir varsayımdı, birinin elementteki her bir elektronu göreli olarak ele alarak hesaplamaları titizlikle yapması ve ilgili özellikleri hesaplaması gerekiyordu. Bu durumda ilgili özellik, katıdan sıvıya geçiş gibi faz geçişleri sırasında değeri çarpıcı bir şekilde değişen ısı sığasıydı.
Eldeki soru basitti: En modern hesaplamaları kullanarak, ısı sığasındaki ani bir değişimi kullanarak cıvanın erime noktasını hesaplayabilir miyiz?
Angewandte Chemie dergisinde yayınlanan makalede; Yeni Zelandalı, Alman ve Fransız kimyagerler, bugüne kadarki en eksiksiz sonucu elde ettiler. Cıvanın erimesini, kuantum moleküler dinamiklerini kullanarak, Schrödinger denklemini çözerek, kuantum mekaniğinden kuvvetleri ve hızları hesaplayarak ve atomik kümelerin rastgele farklı yönelimleri örneklemesine izin vererek simüle ettiler. Hesaplamaları önce göreliliği dahil etmeden ve daha sonra dahil ederek gerçekleştirdiler - ve sonuçlar netti: Görelilik hesaba dahil edildiğinde, cıvanın erime noktası, deneyle mükemmel bir uyum içinde ve ısı sığasındaki ani bir değişiklikle birlikte 355 Kelvin'den 250 Kelvin'e düşmüştü.
Özel Görelilik, Kimyaya Işık Tutuyor!
Bu özel teorinin açıkladığı tek şey cıvanın neden oda sıcaklığında sıvı halde olduğu değildir. Aynı zamanda altının neden sarı olduğunu veya gümüşün neden beyaz olduğunu da açıklar. Bu durumda, yörüngelerin bölünmesi ve 6s orbitalinin daha düşük olan enerjisi, altının mavi ışığı soğurmasına ve sarı ile kırmızı ışık yaymasına neden olur. Gümüşte 6s seviyesi daha yüksek olduğundan, bir elektronu uyarmak için gereken enerji, spektrumda görünür bölge yerine morötesi bölgeye denk gelir. Sonuç olarak gümüş, spektrumun görünür bölgesinde renklerden yoksun olarak görünür.Kaynak: Evrim Ağacı
